多細胞生物においては、細胞内外環境の恒常性維持が細胞の生存にとって本質的意味を持つ。細胞の内外環境を一定に保つためには、脂溶性の低分子物質は受動拡散により通過できるが、無機イオンや生体代謝に関与する多くの水溶性有機物質は、原則的に脂質二重層膜は不透過であり、それらの膜通過には特別な「通路」を必要とする。これが膜タンパク質より成るイオンチャネルであり、トランスポーターである。興奮性細胞の電気的活動が細胞膜のイオン透過性の選択的で動的な変化に起因することから「チャネル」の概念が生まれた。また、興奮により撹乱されたイオン環境からの回復に、電気化学ポテンシャルに逆らって輸送する系としての「Na-Kポンプ(トランスポーター)」の存在が明らかにされた。この段階から、チャネルとトランスポーターの研究が開始されたと言える。その後膜電位固定法やパッチクランプ法によりチャネル電流を、膜小胞による輸送実験によってトランスポーター活性を調べることにより、輸送タンパク質の機能特性の解析が行われ、1980年代から 1990年代の遺伝子クローニングによる膜輸送分子の実体解明へと進んだ。さらに最近では一部のチャネル・トランスポーターにおいてその三次元構造が解明され、生体膜での物質透過機構が原子レベルで理解されるに至っている。
チャネル・トランスポーターの分子実体解明に続き、嚢胞性繊維症のCFTR Cl-チャネルに代表されるように、これらの遺伝子異常による疾患(チャネル病・トランスポーター病)が明らかにされた。この中には膜輸送分子自体の異常のみならず、それを調節する感受装置からのシグナル(ホルモン等)がレセプター異常により伝達されない場合や、膜輸送体タンパク質に対する抗体が産生されて膜輸送が障害される場合、さらにトラフィッキングの障害により細胞膜上に適正に移動できずに膜輸送が障害される場合などの例が見つかるにつれ、チャネル・トランスポーターを中心とした膜輸送機能ユニットとしての分子複合体「トランスポートソーム」の概念へと至った。
チャネル、トランスポーターを包含したトランスポートソーム研究は、細胞から個体レベルの恒常性の理解に不可欠な成果を提供することにより、基礎生物学の発展に大きく寄与すると期待される。特に、増殖因子シグナル伝達系と膜輸送系との間の機能的クロストークが解明され始めた状況を考慮すると、トランスポートソーム研究の細胞生物学領域での重要度がますます高まることは間違いない。また、トランスポートソーム研究は臨床医学への貢献も極めて高い領域と言える。実際に、研究成果はヒトcommon diseasesの基盤を理解するために必須な情報であるとともに、生体膜輸送分子の遺伝子変異が多くの遺伝性疾患や薬物代謝異常の原因であることが次々に明らかにされている。
主要なチャネル・トランスポーター群の分子実体が解明され、ポストゲノム時代を迎えた現在、トランスポートソーム研究の主要課題は本特定領域研究における3つの研究項目に集約される。すなわち、単に輸送分子群のみに留まらず、その生理機能獲得機構、活性制御機構、細胞内局在機構などに関与する分子群をも包括したトランスポートソームの全容解明である。これらの課題解決のためには、第一線のトランスポートソーム研究者が有機的・統合的に協力し、現象論的手法からコンピュータシュミレーション等をも包含する分子論的手法までの総ての多面的アプローチを結集することが不可欠となっている。以下に、トランスポートソーム研究の近年の経緯と今後の展望について、本特定領域研究計画班員の成果の具体例を含めて解説したい。
生体膜に内在する小分子輸送を司る機能分子がタンパク質であることが一般的に認識されたのは、1970年代半ばからである。1970年代後半には、薬物や毒素などの特異的リガンドを利用して、先駆的なチャネルやトランスポ?ターの薬理学的解析やタンパク質としての生化学的精製が試みられた。1980年代始めに、トランスポートソーム構成分子として最初のニコチン性アセチルコリン受容体の遺伝子クローニングが、世界に先駆けて我が国で達成されて以来、多彩な膜輸送分子群の分子同定が行われてきた。さらに、1990年代後半から技術改良された遺伝子解読技術の進展とデータベースの整備により、今日に至るまでゲノム情報からの多彩な膜輸送分子ファミリーの解明が急速に進んだ。
膜輸送体分子の実体解明に関して、本特定領域研究班員の貢献は多大であることを強調したい。チャネル分子同定では、竹島らによるCa2+放出チャネル/リアノジン受容体(Nature 1989)、森らによる電位依存性Ca2+チャネル(Nature 1991)、佐々木・内田らによるアクアポリン(Nature 1993)などが代表例である。トランスポーターに関しては、金井らによるアミノ酸(グルタミン酸)トランスポーター(Nature 1992)、尿素トランスポーター(Nature 1993)、オリゴペプチドトランスポーター(Nature 1994)、宮本らによるリン酸トランスポーター(J.Biol.Chem. 2002)、鈴木らによるcMOAT/MRP2 (Am.J.Physiol. 1997)が列挙される。これらを含む重要な貢献により、基本的な膜輸送分子群の構造的特徴が解明され、そのファミリー分子群の多様性が解明されるに至っている。
1990年代になると遺伝子機能発現実験が一般化し、生体膜輸送の細胞レベル機能解析を行う薬理生理学や1分子レベルの機能解析を手掛ける生物物理学などと、分子同定を専門とする生化学との間で、融合研究による成果が多数発表されるようになった。その成果として、生体膜輸送分子群の有する組織特異性、基質選択性、薬物感受性などの機能上の多様性も分子レベルで解明された。さらに、1990 年半ば以降になると遺伝子改変マウスの作製技術が広まり、個体レベルの生理学や形態学、生化学の融合研究による成果が輸送分子研究においても多く発表された。また、微量に発現する生体膜輸送分子は構造生物学における研究対象には本来なり得ないと思われてきたが、遺伝子実験手法により生体膜輸送分子をも三次元構造解析の標的とすることも可能となった。電位依存性K+チャネルの立体構造を解いたMackinnon教授のノーベル賞受賞が記憶に新しい。上述のように、トランスポートソーム研究は総ての実験生物学領域に跨る学際的研究へと現在では発展を遂げており、チャネル構造生物学や輸送分子と薬物の相互作用を扱う分子薬理学分野においてはコンピューターモデリングなどのin silicoドライ解析研究も導入されている。
上記の研究経過においても、本特定領域研究の班員は重要な実績を有する。ヒト疾患に関する研究においては、金井らによる尿酸再吸収機構の解明(Nature 2002)、アミノ酸尿症原因遺伝子の解明(Nat.Genet. 2004)、鈴木らによる薬物排泄とトランスポーター遺伝子多型の関連解明(Clin.Pharmacol.Ther. 2003)、寺崎らによるトランスポーターによる抗癌剤脳移行の制御解明(Life Sci. 1992)などが特記される。変異マウスによる研究では、竹島らによるリアノジン受容体(Nature 1994)、内田らによるClCチャネル(Nat.Genet. 1999)、森らによる電位依存性Ca2+チャネル(J. Neurosci. 2000; Nat.Genet. 2004)などの解析がある。また、古川らによる心筋K+チャネルMinKの分子複合体形成(J.Mol.Biol. 2001)、倉智・日比野らによる内向き整流K+チャネルの活性調節機構の解明(Nature 1987; EMBO J. 2000)、根本・河西らによるCa2+シグナルと開口分泌機序の解析(Nat.Cell.Biol. 2001)、木下らによるKATPチャネルの構造シュミレーション(Circ.Res. 2002)などもトランスポートソーム研究にて新たな道を拓く成果として評価されている。
チャネル、トランスポーターの分子自身の遺伝子同定、生理的機能解析、病態との関連分析が近年急速に進展してきた過程で、謎に満ちた新たな重要課題が現れ始めている。その課題とはすなわち、輸送分子が生理的に機能するためには多様な活性制御機構を集積しながら細胞膜上の特定の場所に局在する必要があるが、その機構や制御に関してはまったく不明であるということである。好例としては、心臓の自律神経制御において、迷走神経刺激で心筋細胞のムスカリン性アセチルコリン(M2)受容体が最初に活性化し、次いでG タンパク質制御性内向き整流K+チャネル(GIRK)が活性化され、心拍数が低下する現象が上げられる。興味深いことに、このK+チャネル活性化は、同様の分子機序を有するアドレナリン性のGタンパク質活性化では決して引き起こされないことから、M2受容体-Gタンパク質-GIRKの機能複合体の形成と、その複合体が迷走神経直下に偏在することを想定する必要がある。また別例として、腎尿細管のバゾプレシンによる水再吸収も挙げられる。血中バゾプレシンの受容のためにその受容体は尿細管細胞の基底膜に分布し、受容体活性化とそのシグナルカスケードにより、内膜系に存在している水チャネル(AQP2)は頂上膜選択的にリクルートされ、再吸収促進が起こる現象がある。この現象については、AQP2の局在機構やその制御などに関して精巧な分子機構が推定されるが、詳細はまったく不明である。
細胞膜上特定部位への組み込み、集積、局在維持、さらにはそれらの制御に類する謎は、ほぼ全ての膜輸送の研究で考察され始めている。従って、現状のトランスポートソーム研究の成果に立脚し、膜輸送の生理機能の理解をさらに深めるためには、想定される膜輸送の機能ユニットとしての複合体の分子構築を解明し、その局在機構や活性制御機序を細胞膜コンパートメントや細胞極性との関連を含めて丹念に明らかにすることが必須である。
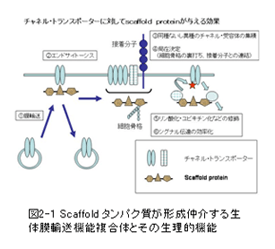
受容体刺激によるシグナル伝達解析に端を発した足場(scaffold)タンパク質の研究は、トランスポートソーム研究にも波及し始め、幅広い研究展開が期待されている。トランスポートソームにおけるscaffoldタンパク質の役割は、単に細胞膜での裏打による生体膜輸送分子の集積にとどまらず、膜輸送やエンドサイトーシスによる生体膜輸送分子の表層膜上での量的制御、細胞接着受容体や細胞骨格との連結による生体膜輸送分子の局在制御、シグナル分子の集積や生体膜輸送分子の修飾による質的制御、など多岐に渡るものと理解されようとしている(図2-1参照)。この視点に基づいた生体膜輸送分子とscaffoldタンパク質の相互作用を機軸とする生体膜輸送分子複合体の分子構築の解明は、間違いなく今後のトランスポートソーム研究の最重要課題の1つであり、強力に推進すべき研究分野である。ポストゲノム時代が到来した今日では、新規なscaffoldタンパク質の同定研究から、新規な分子間相互作用の同定研究へと変遷することが予想され、生体膜輸送分子群と受容体/シグナル伝達分子群との間の相互作用を介したクロストーク研究へと近い将来発展すると考えられる。最近、本特定領域研究の班員からも、トランスポートソームのミクロアセンブリに関する優れた萌芽的研究成果が報告されており、この研究の流れを後押ししている。
 神経細胞、特に興奮性の神経シナプスの後肥厚には膜タンパク質を裏打ちする複数の scaffoldタンパク質が存在し、細胞骨格、シグナル伝達分子、接着分子を含む複雑な分子ネットワークを形成している。畑は、イオンチャネル型グルタミン酸受容体を裏打ちするPDZタンパク質S-SCAMを見出し(J.Biol.Chem 1998)、S-SCAMが他のscaffoldタンパク質PSD-95やMAGUINとも相互作用し、興奮性シナプス後肥厚におけるチャネル・接着分子を中心とする分子集積に重要な役割を果たすことを明らかにしている(J.Neurosci. 2002; Mol.Cell Neurosci. 2004)。また細胞間接着部位においても、複数のscaffoldタンパク質が存在し、接着分子、受容体、膜輸送分子が細胞骨格とネットワークを形成している。中西らは、PDZドメインを持つアクチン結合タンパク質のアファディンを見出し、これが接着分子ネクチンのscaffoldタンパク質として機能するとともに、他のscaffoldタンパク質との相互作用を介して別の接着分子や受容体の局在や集積に決定的な役割を果たしていることを明らかにしている(J Cell Biol 2000)。
神経細胞、特に興奮性の神経シナプスの後肥厚には膜タンパク質を裏打ちする複数の scaffoldタンパク質が存在し、細胞骨格、シグナル伝達分子、接着分子を含む複雑な分子ネットワークを形成している。畑は、イオンチャネル型グルタミン酸受容体を裏打ちするPDZタンパク質S-SCAMを見出し(J.Biol.Chem 1998)、S-SCAMが他のscaffoldタンパク質PSD-95やMAGUINとも相互作用し、興奮性シナプス後肥厚におけるチャネル・接着分子を中心とする分子集積に重要な役割を果たすことを明らかにしている(J.Neurosci. 2002; Mol.Cell Neurosci. 2004)。また細胞間接着部位においても、複数のscaffoldタンパク質が存在し、接着分子、受容体、膜輸送分子が細胞骨格とネットワークを形成している。中西らは、PDZドメインを持つアクチン結合タンパク質のアファディンを見出し、これが接着分子ネクチンのscaffoldタンパク質として機能するとともに、他のscaffoldタンパク質との相互作用を介して別の接着分子や受容体の局在や集積に決定的な役割を果たしていることを明らかにしている(J Cell Biol 2000)。
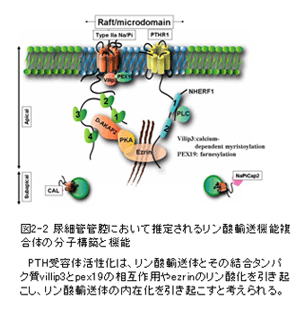
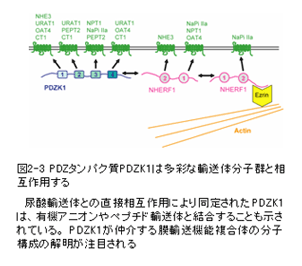
尿細管のリン酸再吸収を担当するリン酸輸送体は、副甲状腺ホルモンPTHや食餌リン酸含有量などにより細胞膜での発現量が調節される。宮本らはこの機構にPDZタンパク質と、細胞骨格をつなぐタンパク質ezrinのリン酸化が重要であることを明らかにするとともに、リン酸輸送体と相互作用するファルネシル化タンパク質PEX19等を同定し、尿細管管腔膜における複数のscaffoldタンパク質を仲介したPTH受容体とリン酸輸送体の巨大複合体の機能解明を目指している(図2-2参照)。金井らは尿酸輸送体(URAT1)と直接相互作用する PDZタンパク質であるPDZK1を同定し、尿酸輸送活性がその相互作用により増強することを見出しており、PDZK1により形成される膜輸送複合体の分子構築の解明を目指している(図2-3参照)。森らは形質膜Ca2+流入チャネルTRP、小胞体Ca2+放出チャネル、及びフォスフォリパーゼCが複合体を形成し、シグナルの増幅・協調を司ることを既に報告した(EMBO J. 2003)。
 膜輸送複合体トランスポートソームの細胞レベルでの機能の解明には、複合体の分子構築の理解に加えて、細胞膜のコンパートメント、細胞極性、オルガネラ間機能共役などとの連関を理解する必要がある。カベオラやラフトと呼ばれる特殊化した細胞膜上に輸送分子が集積する報告が散見するようになってきたが、その集積機序、輸送分子とリン脂質や特殊細胞膜との相互作用などの詳細は明らかにされていない。また、神経細胞や上皮細胞などにおける輸送分子の極性特異的な細胞膜への組み込み機構についても、例外的な輸送分子を除き不明である。さらに、細胞内Ca2+シグナルや有機酸代謝などにおいて、ミトコンドリアを中心にオルガネラ間の輸送分子機能共役が現象論的に示唆され始めたが、その分子機序の詳細は依然明らかにされていない。これらの疑問は、膜輸送複合体の分子構築の解明の1段階上の階層に位置づけられるが、トランスポートソーム研究の最重要課題であり、早急に取り組む必要がある。細胞内環境とトランスポートソームの機能の連関については、断片的な成果が本特定領域研究班員によっても最近報告されており、今後の進展が期待される。
膜輸送複合体トランスポートソームの細胞レベルでの機能の解明には、複合体の分子構築の理解に加えて、細胞膜のコンパートメント、細胞極性、オルガネラ間機能共役などとの連関を理解する必要がある。カベオラやラフトと呼ばれる特殊化した細胞膜上に輸送分子が集積する報告が散見するようになってきたが、その集積機序、輸送分子とリン脂質や特殊細胞膜との相互作用などの詳細は明らかにされていない。また、神経細胞や上皮細胞などにおける輸送分子の極性特異的な細胞膜への組み込み機構についても、例外的な輸送分子を除き不明である。さらに、細胞内Ca2+シグナルや有機酸代謝などにおいて、ミトコンドリアを中心にオルガネラ間の輸送分子機能共役が現象論的に示唆され始めたが、その分子機序の詳細は依然明らかにされていない。これらの疑問は、膜輸送複合体の分子構築の解明の1段階上の階層に位置づけられるが、トランスポートソーム研究の最重要課題であり、早急に取り組む必要がある。細胞内環境とトランスポートソームの機能の連関については、断片的な成果が本特定領域研究班員によっても最近報告されており、今後の進展が期待される。
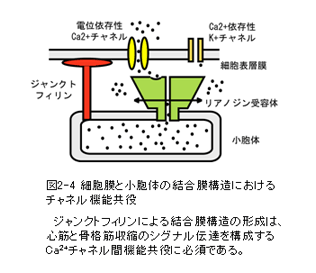
竹島らは細胞表層膜と小胞体膜を架橋する新規タンパク質であるジャンクトフィリンを見出し(図2-4参照)、筋細胞における電位依存性Ca2+チャネルとリアノジン受容体の機能共役にジャンクトフィリンが必須であることを示した (Mol.Cell 2000; J.Cell Biol. 2001)。日比野らはグリア細胞における内向き整流K+チャネルのラフト分画への局在と神経細胞の活動制御の関係に着目した研究を遂行中である (J.Biol.Chem. 2004)。末次らはホスホイノシタイド結合タンパク質に着目し、神経突起伸長やグルコース輸送体活性制御に関する機能を明らかにしている (Nat.Cell.Biol. 2004; Dev.Cell 2003)。楠見らはユニークな細胞表層膜上の一分子イメージング手法を有しており(PNAS 2004; Nat.Cell.Biol. 2003)、トランスポートソーム分子と細胞骨格系との関連を明らかにすることを目指している。
既知の輸送分子群においても今なお個体レベルの生理機能が不明のものも多く存在する。遺伝子改変マウスの作製と解析に加えて、組織および細胞レベルの生理・薬理学的実験により、それぞれの分子の生理機能を明らかにすることが重要である。一方、遺伝子の変異や多型と疾患感受性や薬物感受性との間の関係を解明することの重要性も自明である。臨床医学・創薬研究にも直結するこの研究分野から、画期的な分子診断法やオーダーメイド治療の確立、新規な創薬標的分子の同定につながることが期待される。
トランスポートソーム分子群の生理機能解明のための技術として、特にシグナル伝達系の可視化解析の分野で大きな成果をあげつつある先端的な光学的手法があげられる。先述の楠見らの一分子イメージングに加え、根本は近赤外フェムト秒パルスレーザーによる多光子励起過程を用いた膜動態の解析法を開発し、分泌小胞の開口放出の素過程の可視化を初めて成功させた。さらにこの技術を用い、逐次開口という新しい様式を実証した (Nat.Cell Biol. 2001)。また末次らはこれまで取り扱いの難しさから解析の対象とならなかったトランスポートソームにおける脂質の役割の解明に有効な、ELISA法による脂質結合活性測定法を開発した。さらに臨床医学・創薬研究に向けた画期的な方法論として、鈴木らは単層培養した極性細胞(MDCK II細胞)に、OATPおよびABCC2を共発現させ、薬物の体内動態を予測するためin vitroでベクトル輸送を検出できる系を確立し(J.Biol.Chem. 2002)、寺崎らは血液脳関門の物質排出輸送速度を直接測定できる唯一の系として国際的に認知されているBrain Efflux Index法を開発している。遺伝子改変マウスとしては、佐々木・内田らのClC-KおよびClC-3イオンチャネルKOマウス(Nat.Genet. 1999)や仁科らのシグナル伝達因子SEK1およびMKK7 KOマウス(Nat.Cell Biol. 2004)の利用が本特定領域研究の推進に効力を発揮すると期待される。